Über die letzten Jahrzehnte hat sich unser Verständnis von Autismus nach und nach gewandelt. Mittlerweile wird er nicht mehr als eine einheitliche Erkrankung, sondern als multidimensionale Störung angesehen, oder auch als komplexer Phänotyp (unterschiedliche Ausprägungen), weswegen man heutzutage von einer „Autismus Spektrum Störung “ (autism spectrum disorder, „ASD“) spricht, die sich in unterschiedlichen Schweregraden mit unterschiedlichen Ausprägungen ausdrücken kann, von leichten Charakterzügen bis hin zu schwerwiegender Behinderung. Eingeschlossen sind hier frühkindlicher Autismus (Kanner Syndrom), Asperger Syndrom, atypischer Autismus, das Rett-Syndrom, hochfunktionaler Autismus und die sonstige tiefgreifende Entwicklungsstörung. Oftmals treten Begleitsymptome auf wie Tourette-Syndrom, AD(H)S, Angststörungen, Epilepsie, Phobien, Depressionen, Stottern, Zwangsstörungen, Essstörungen, Schlafstörungen…
Ebenso vielfältig sind die Gründe für diese Störung. Bei ASD sind nicht nur das Gehirn, sondern auch weitere Organsysteme betroffen. Bislang lag das Augenmerk in erster Linie auf genetischen Faktoren. Es konnte eine ganze Reihe an Genen identifiziert werden, die in einem Zusammenhang mit ASD vermutet werden, allerdings besteht hier eine sehr große Heterogenität zwischen den Betroffenen (sehr viele unterschiedliche verantwortliche Gene in verschiedenen Betroffenen), sodass relativ wenig Aussage getroffen werden kann. Außerdem geben sie eher Aussage über eine größere Wahrscheinlichkeit einer Betroffenheit, als dass sie als unmittelbar verursachend angesehen werden können. Auch die Obduktion von Gehirnen verstorbener Betroffener zeigt eine hohe anatomische Heterogenität mit Auffälligkeiten in unterschiedlichen Bereichen.
Die Tatsache, dass Zwillingsstudien zeigen, dass bei eineiigen Zwillingen die Wahrscheinlichkeit hoch ist, dass im Falle eines Auftretens von Autismus beide Kinder betroffen sind, während das Risiko bei zweieiigen Zwillingen und den übrigen Geschwistern äußerst gering ist, aber eben auch bei einem gewissen Anteil an eineiigen Zwillingen nur ein einzelnes Kind betroffen ist, zeigt, dass hier mehr dahinter stecken muss, als nur Vererbung, es scheint vielmehr zu einer Einwirkung während der Schwangerschaft zu kommen, die zu de novo Mutationen geführt hat. Auch ist Vererbung als Hauptursache aus dem Grund unwahrscheinlich, da ASD-Betroffene durchschnittlich weniger Nachkommen zeugen, sich ASD aber konstant in der Bevölkerung hält, eher sogar im Steigen begriffen ist. Die Tatsache, dass die Vererbung von ASD nicht den Mendelschen Regeln folgt, zeigt, dass hier Umweltfaktoren dahinter stecken müssen, die darüber entscheiden, ob ein Träger einer anfälligen Genvariante erkrankt oder nicht. Ein Risikofaktor für eine de novo Mutation ist das fortgeschrittene Alter der Eltern, besonders des Vater bei der Zeugung (Spermien sind extrem anfällig für Schäden durch oxidativen Stress durch freie Radikale, während Eizellen noch recht ausgeklügelte Reparaturmechanismen besitzen).
Zu den weiteren Risikofaktoren vor Empfängnis und Geburt (nicht nur für Autismus sondern auch für ADHS, geringer IQ,… und ) zählen eine Aussetzung von Mutagenen wie Schwermetallen und Chlorverbindungen wie Quecksilber, Cadmium, Nickel, Trichlorethylen, Vinylchlorid (verbrauchen Antioxidantien wie das „Masterantioxidans“ Glutathion im hohen Maß, und binden an Schwefelgruppen von Proteinen), aber auch Faktoren wie Vitamin D Mangel und das Leben in höheren Breitengraden, Stadtleben, Leben in Fabriknähe, Leben in Ländern mit höherem Niederschlag und TV-Konsum. Vitamin D ist wichtig für eine gesunde Hirnentwicklung und hat antimutagene (gegen Mutationen), zellreparierende Eigenschaften, spielt außerdem bei der Aktivierung von Glutathion (sehr wichtiges körpereigenes Antioxidanz zur Entgiftung) eine wichtige Rolle. Bei Individuen mit einer bestimmten Genvariante kann es zu neuronalen Fehlentwicklungen und somit zu ASD kommen, wenn sie als Fötus Organophosphaten ausgesetzt werden über das Blut der Mutter, die häufig in Pestiziden und Insektiziden Verwendung finden. Das Ethylquecksilberderivat Thiomersal in Impfstoffen wird ebenfalls kontrovers als ein möglicher Faktor diskutiert. Genannte Stoffe können auch eine Rolle bei neurodegenerativen Erkrankungen wie Parkinson und Alzheimer spielen und zeigen, dass das Gehirn ein sensibles Organ ist.
Doch immer mehr rücken auch epigenetische Veränderungen und Umwelteinflüsse in der frühen Kindheit in den Vordergrund, wie Ernährung und chemische Belastung, auch da bei vielen Kindern sich die Störung erst etwa ab dem dritten Lebensalter entwickelt. In Bezug auf Asthma und Allergien ist der Zusammenhang mit Schadstoffen schon lange bekannt, doch neuere Studien zeigen inzwischen auch einen Zusammenhang zu kognitiven Störungen. Besonders Kinder sind hiervon betroffen, wahrscheinlich, da sie relativ zu ihrem Körpergewicht mehr Nahrung zu sich nehmen und eine höhere Atemfrequenz besitzen, der Stoffaustausch mit der Umwelt also höher ist, ihre Barriereorgane außerdem noch nicht voll entwickelt sind. Gerade auch, weil Kinder heutzutage mehr und mehr Zeit in Innenräumen verbringen, ist dies von Interesse. Es konnte ein statistisch signifikanter Zusammenhang zwischen Atemwegserkrankungen wie Asthma und ASD gefunden werden – Kinder mit ASD haben ein etwa doppelt so hohes Risiko zu erkranken. Desweiteren besteht ein Zusammenhang für die Entstehung von ASD bei Kindern mit Atopischem Ekzem und Allergien der Mutter und Sick Building Syndrom beider Eltern (Gesundheitprobleme ausgelöst durch mangelnde Belüftung, chemische und biologische Belastung wie Schimmel in Gebäuden, in denen man sich viele Stunde aufhält, wie Zuhause und Arbeitsplatz, Begriff definiert durch die WHO).
Bei Familien mit ASD-betroffenen Kindern waren in einer polnischen Studie signifikant häufiger PVC-Böden in den Schlafräumen der Eltern und Kinder zu finden als bei Familien ohne ASD-betroffener Kinder. In der Regel manifestierte ASD sich wenige Jahre nach Verlegung der PVC-Böden. Ebenso wurde signifikant vermehrt von Kondensation an den Fensterscheiben berichtet, ein Zeichen für eine schlechte Lüftung während der Heizperiode. PVC Böden sind eine wichtige Quelle für Phtalate, die sich im Hausstaub niederschlagen und für die bereits ein Zusammenhang mit Allergien und Asthma nachgewiesen wurde, genauso wie Formaldehyd, Spanplatten, Plastik, Teppichböden, Reinigungsmittel und frische Anstriche. Phtalate sind bereits dafür bekannt, hormonstörende Wirkung zu besitzen.
Das Aufwachsen von Kindern in einem Haushalt mit rauchenden Familienmitgliedern korrelliert ebenfalls mit einer beeinträchtigten kognitiven Funktionalität. Dies ist besonders ausgeprägt bei einer rauchenden Mutter, während der Schwangerschaft sowie nach der Geburt.
Ebenso stellt ein Schimmelbefall des Elternhauses einen hohen Risikofaktor für eine gestörte kognitive Entwicklung dar, wie inzwischen nachgewiesen werden konnte. Studien an Erwachsenen konnten bereits schwerwiegende neurologische Beeinträchtigung durch Mykotoxine (Schimmelgifte) nachweisen, wie Störungen im Gleichgewichtssinn, Reaktionszeit, Blinzelreflex, Sehstörungen, Depressionen und verschlechtertes Abschneiden bei kognitiven Tests. Eine schwedische Studie konnte eine positive Korrelation zwischen Feuchtigkeit, Schimmel und Schadstoffemissionen am Arbeitsplatz mit einem erhöhten Risiko für Sick building Syndrome, Atemwegserkrankungen, einem erhöhten Lysozymgehalt im Schleim und erhöhte eosinophilische Entzündungsmarker im Blut feststellen. Bei längerer Absenz von dem betroffenen Gebäude konnte in vielen Fällen eine deutliche Verbesserung des Befindens festgestellt werden.
Als weitere Umweltfaktoren konnte eine pränatale oder perinatale Aussetzung mit Viren, wie Rubella und Herpes, nachgewiesen werden.
Ein weiteres Problem stellt die Tatsache dar, dass ASD-Betroffene oftmals eine eingeschränkte Entgiftungsfähigkeit besitzen, was erklären kann, dass nicht alle Familienmitglieder bei gleicher Lebenssituation die gleichen kognitiven Symptome zeigen. Viele zeigen eingeschränkte Methylierung (u. a. biochemische, körpereigene Inaktivierung von Toxinen, aber auch Signalregulierung von DNA (Epigenetik), Herstellung von Neurotransmittern,…) und Zeichen oxidativen Stresses, was allerdings wiederum verursacht sein kann durch negative Einwirkungen auf den Schwefelmetabolismus (Hauptentgiftungsmechanismus des Körpers auf Zellebene; besonders Quecksilber bindet an Schwefelgruppen) und damit den zellulären Redoxstatus (Gleichgewicht zwischen Oxidantien, also freien Radikalen und Antioxidantien, wovon die zelluläre Homöostase abhängt) durch Umweltgifte. Ist die zelluläre Homöostase (Gleichgewicht) gestört, führt dies zu einer eingeschränkten Funktion bis hin zum Zelltod, auch bei Neuronen. Neuronen zeigen sich als extrem sensitiv gegenüber Schwermetallen. Leider durchdringt gerade Methylquecksilber sehr gut die Blut-Hirn-Schranke.
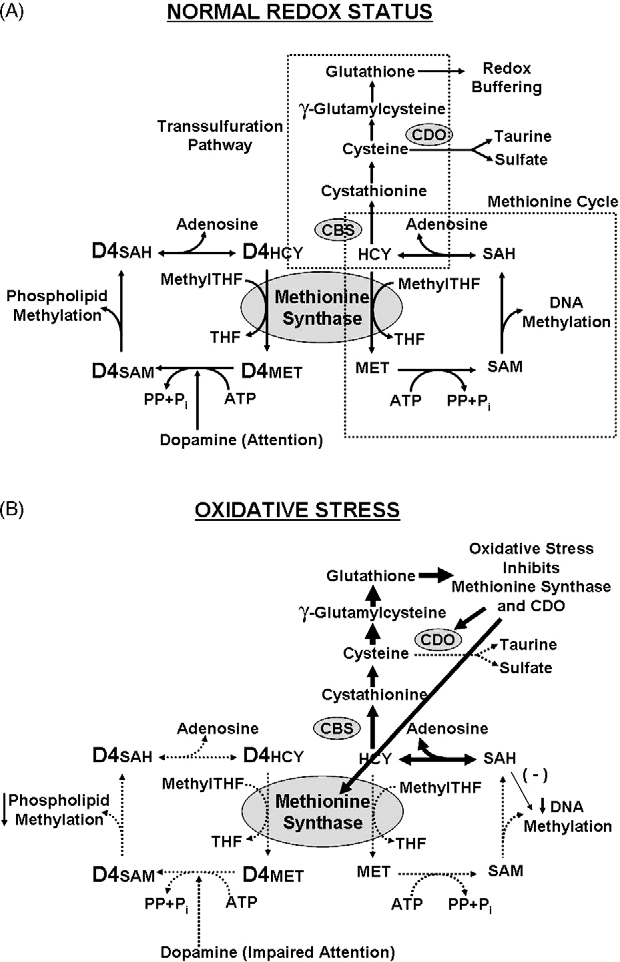
Diese Schwermetalle, Pestizide (von denen viele eigens dafür geschaffen wurden, Redoxreaktionen zu unterbinden als Wirkmechanismus) sowie Alkohol können durch oxidativen Stress zu einer Hemmung der Methionin Synthase (ein Enzym, das abhängig ist von Folat und Vitamin B12) führen, die u.a. dafür verantwortlich ist, Homocystein (HCY) in die Aminosäure Methionin umzuwandeln, ein entscheidender Methylgruppenspender. Die Methionin Synthase spielt außerdem eine entscheidende Rolle im Dopaminhaushalt, der bei ASD und ADHS gestört ist. Dopamin ist ein wichtiger Neurotransmitter, der für Motivation und Konzentrationsfähigkeit zuständig ist. Viele Autisten zeigen Genvarianten, die für eine höhere neuronale Synchronisation (Kohärenz) und damit höhere kognitive Fähigkeiten sorgen, was aber gleichsam einhergeht mit einer höheren Anfälligkeit gegenüber Störungen, z.B. durch Schwermetalle.
Nicht nur bei Kindern mit ASD, sondern auch mit ADHS wurden in diversen Studien erhöhte Plasmawerte an Blei und Quecksilber gefunden. Erhöhte Homocysteinwerte im Blut werden im Zusammenhang gesehen mit kognitiven Störungen wie geistiger Behinderung, Depressionen und Demenz, ebenso wie mit Gefäßerkrankungen. Typisch sind ebenfalls niedrige Werte des wichtigen Antioxidanz S-Adenosylmethionin (SAMe).
Der oxidative Stress, der durch die Schwermetalle verursacht wird, sorgt gleichsam dafür, dass die Schwermetalle schlechter ausgeschieden werden können, ein Teufelskreis.
Ebenso ist die Methionin Synthase ein wichtiger Bestandteil der Glutathion-Synthese, des bereits erwähnten Masterantioxidanz des Körpers. Ein weiteres entscheidendes Enzym hierbei ist die Cystathionin-β-Synthase (Vitamin B6 abhängig). Beide Enzyme sorgen zusammen für eine Balance zwischen Methylierung und Redoxpufferung. Ihre Aktivität wird durch Testosteron verringert, was mit eine Erklärung dafür sein kann, warum Autismus in der männlichen Bevölkerung deutlich mehr auftritt.
Ein weiteres wichtiges Enzym im Methylierungsprozess, der Glutathionsynthese und des Homocysteinabbaus zu Methionin ist die Methylentetrahydrofolat Reduktase (MTHFR). Sie syntethisiert Methylfolat (methylierte Form von Folsäure), einem Methyldonor für die Methioninsynthese. Kleine genetische Variationen, bei denen es nur einen Unterschied in einem einzelnen Basenpaar der DNA gibt (Einzelnukleotid-Polymorphismen, single nucleotide polymophisms (SNPs)) im MTHFR-Gen und eine damit einhergehende eingeschränkte Funktion kommen verhältnismäßig häufig vor (die Punktmutationen C677T und A1298C kommen in ca. 40% der Bevölkerung heterozygot und in 5-20% der Bevölkerung homozygot vor >> Aktivitätsverlust der MTHFR von bis zu 60% >> Erhöhung des Homocysteinspiegels bei Folatmangel). Bei Autisten werden die Punktmutationen C677T und die kombinierten Varianten C677T plus A1298C signifikant häufiger gefunden als in der übrigen Bevölkerung. Es wurden allerdings noch zahlreiche andere mögliche Genvarianten bei entdeckt, die zu Störungen im Methylierungsprozess bei Anwesenheit von Schadstoffen führen können.
Wenn die Methionin Synthase gehemmt ist durch oxidativen Stress, werden alle Methylierungsprozesse gehemmt, auch DNA Methylierung, was zu einer erhöhten Exprimierung (Anschaltung) von Genen sorgt, also einer veränderten epigenetischen Ausprägung, die z.B. bei Entzündungsreaktionen eine Rolle spielen. Autistische Kinder zeigen in der Tat erhöhte Entzündungsmarker wie Cytokine und Histamin, Obduktionen zeigten höhere Mikroglia-Aktivität (die Makrophagen des Gehirns, werden ebenfalls durch Quecksilber stimuliert, schütten dann zusätzlich entzündungsfördernde Substanzen aus), was auf entzündliche Geschehen im Gehirn deutet. Doch auch andere chronisch entzündliche Erkrankungen, die nicht-neuronales Gewebe betreffen, wie Autoimmunerkrankungen, höhere Mastzellaktivität, allergische oder gastrointestinale Erkrankungen korrelieren häufig mit Autismus. Hält dieser epigenetische Effekt durch oxidativen Stress über einen langen Zeitraum an, kann es zu krankhaften Auswirkungen für den Betroffenen kommen.
Wie stark ein Individuum auf Schadstoffe reagiert, hängt von seiner genetischen Ausstattung ab. Ob es dann zu gesundheitlichen Problemen kommt, hängt aber letztendlich davon ab, ob der Schadstoff (und in welcher Konzentration) vorhanden ist und wie gut der Ernährungsstatus des Betroffenen ist (die genannte B-Vitamine und Aminosäuren als Cofaktoren und Methylgruppenspender für den Methylierungszyklus) (andernfalls wäre die Prävalenz von Autismus deutlich höher, gemessen an der Häufigkeit vieler SNPs).
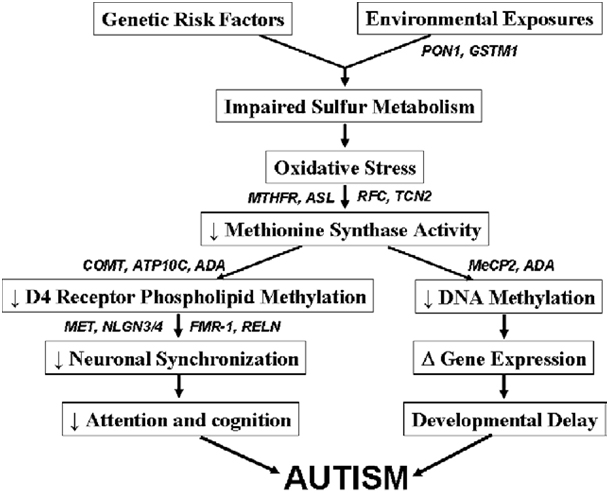
Zusammenfassend kann man sagen, dass die zugrundelegenden, physischen Ursache dieser bislang als kryptischen, „psychischen“ Störung mehr und mehr aufgedeckt werden und es deswegen auch hier, wie bei allen chronischen Erkrankungen, möglich ist, durch Lebensstiloptimierung für Linderung und Prävention zu sorgen.
Konkrete mögliche Ansätze, die sich daraus ergeben wären auf eine gesunde, schadstoff- und schimmelarme Umgebung und Ernährung zu achten, bereits auf einen gesunden Lebensstil der Eltern vor Empfängnis und für eine Unterstützung der körpereigenen Entgiftungsmechanismen zu sorgen.
Die hier gewonnenen Erkenntnisse über das Gehirn können zudem Hinweise geben, wie man auch in der übrigen Bevölkerung einer kognitiven Degeneration entgegenwirken könnte.
Besserung bei autistischen Patienten konnten außerdem erzielt werden mit einer Supplementation von Betain (wichtiger Spender von Methylgruppen), Methylcobalamin (Vitamin-B12, methylierte Formen einzunehmen erleichtert dem Körper die Arbeit und spart Methylgruppen) und Folinsäure (5-Formyltetrahydrofolsäure, Leucovorin, aktive Form der Folsäure, wird besser verstoffwechselt), was zu einer Normalisierung von Schwefelmetaboliten (wie Homocystein) im Plasma führt, was zeigt, dass eine Unterstützung der Methylierungsprozesse und antioxidative Strategien eine wichtige Maßnahme sein können. Auf die Aufnahme ausreichender Antioxidantien und schwefelhaltiger Aminosäuren, sowie auf entzündungssenkende Maßnahmen sollte geachtet werden. Es ist natürlich anzunehmen, dass auch jegliche anderen chronischen Erkrankungen, bei denen auch oxidativer Stress eine Rolle spielt, hiervon profitieren.
You cannot get well in the same environment you became ill in. ~Dr. Jack Kruse
What we observe is not nature itself, but nature exposed to our method of questioning. ~Werner Heisenberg
Quellen:
-
Smalley, S. L., Asarnow, R. F., & Spence, M. A. (1988). Autism and genetics: a decade of research. Archives of general psychiatry, 45(10), 953-961.
-
Jedrychowski, W., Maugeri, U., Perera, F., Stigter, L., Jankowski, J., Butscher, M., … & Sowa, A. (2011). Cognitive function of 6-year old children exposed to mold-contaminated homes in early postnatal period. Prospective birth cohort study in Poland. Physiology & behavior, 104(5), 989-995.
-
Larsson, M., Weiss, B., Janson, S., Sundell, J., & Bornehag, C. G. (2009). Associations between indoor environmental factors and parental-reported autistic spectrum disorders in children 6–8 years of age. Neurotoxicology, 30(5), 822-831.
-
Bornehag, C. G., Sundell, J., & Sigsgaard, T. (2004). Dampness in buildings and health (DBH): Report from an ongoing epidemiological investigation on the association between indoor environmental factors and health effects among children in Sweden. Indoor Air, 14(s7), 59-66.
-
Bornehag, C. G., Sundell, J., Weschler, C. J., Sigsgaard, T., Lundgren, B., Hasselgren, M., & Hägerhed-Engman, L. (2004). The association between asthma and allergic symptoms in children and phthalates in house dust: a nested case-control study. Environmental health perspectives, 1393-1397.
-
Jaakkola, J. J., & Knight, T. L. (2008). The role of exposure to phthalates from polyvinyl chloride products in the development of asthma and allergies: a systematic review and meta-analysis. Environmental health perspectives, 116(7), 845.
-
Hultman, C. M., Sparén, P., & Cnattingius, S. (2002). Perinatal risk factors for infantile autism. Epidemiology, 13(4), 417-423.
-
Croen, L. A., Grether, J. K., Yoshida, C. K., Odouli, R., & Van de Water, J. (2005). Maternal autoimmune diseases, asthma and allergies, and childhood autism spectrum disorders: a case-control study. Archives of pediatrics & adolescent medicine, 159(2), 151-157.
-
Mendell, M. J. (2007). Indoor residential chemical emissions as risk factors for respiratory and allergic effects in children: a review. Indoor air, 17(4), 259-277.
-
Schettler, T. E. D. (2006). Human exposure to phthalates via consumer products. International journal of andrology, 29(1), 134-139.
-
Wilson, V. S., Blystone, C. R., Hotchkiss, A. K., Rider, C. V., & Gray, L. E. (2008). Diverse mechanisms of anti‐androgen action: impact on male rat reproductive tract development. International journal of andrology, 31(2), 178-187.
-
Campbell, A. W., Thrasher, J. D., Gray, M. R., & Vojdani, A. (2004). Mold and mycotoxins: effects on the neurological and immune systems in humans. Advances in applied microbiology, 55, 375-406.
-
Crago, B. R., Gray, M. R., Nelson, L. A., Davis, M., Arnold, L., & Thrasher, J. D. (2003). Psychological, neuropsychological, and electrocortical effects of mixed mold exposure. Archives of Environmental Health: An International Journal, 58(8), 452-463.
-
Baldo, J. V., Ahmad, L., & Ruff, R. (2002). Neuropsychological performance of patients following mold exposure. Applied Neuropsychology, 9(4), 193-202.
-
Brown, R. C., Lockwood, A. H., & Sonawane, B. R. (2005). Neurodegenerative diseases: an overview of environmental risk factors. Environmental health perspectives, 1250-1256.
-
Shenassa, E. D., Daskalakis, C., Liebhaber, A., Braubach, M., & Brown, M. (2007). Dampness and mold in the home and depression: an examination of mold-related illness and perceived control of one’s home as possible depression pathways. American Journal of Public Health, 97(10), 1893-1899.
-
Gordon, W. A., Cantor, J. B., Johanning, E., Charatz, H. J., Ashman, T. A., Breeze, J. L., … & Abramowitz, S. (2004). Cognitive impairment associated with toxigenic fungal exposure: a replication and extension of previous findings. Applied Neuropsychology, 11(2), 65-74.
-
Zhang, X., Sahlberg, B., Wieslander, G., Janson, C., Gislason, T., & Norback, D. (2012). Dampness and moulds in workplace buildings: Associations with incidence and remission of sick building syndrome (SBS) and biomarkers of inflammation in a 10year follow-up study. Science of the total environment, 430, 75-81.
-
Kinney, D. K., Barch, D. H., Chayka, B., Napoleon, S., & Munir, K. M. (2010). Environmental risk factors for autism: do they help cause de novo genetic mutations that contribute to the disorder?. Medical hypotheses, 74(1), 102-106.
-
Rutter, M., & Simonoff, E. (2007). Autism spectrum disorders (including Rett syndrome). Emery and Rimoin’s principles and practice of medical genetics,, 3, 2576-84.
-
Smith, M., Spence, M. A., & Flodman, P. (2009). Nuclear and mitochondrial genome defects in autisms. Annals of the New York Academy of Sciences, 1151(1), 102-132.
-
Gauthier, J., Spiegelman, D., Piton, A., Lafreniere, R. G., Laurent, S., St‐Onge, J., … & Fombonne, É. (2009). Novel de novo SHANK3 mutation in autistic patients. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 150(3), 421-424.
-
Moraine, C., Bonnet-Brilhault, F., Laumonnier, F., & Gomot, M. (2009). Could autism with mental retardation result from digenism and frequent de novo mutations?. The World Journal of Biological Psychiatry, 10(4-3), 1030-1036.
-
Croen, L. A., Najjar, D. V., Fireman, B., & Grether, J. K. (2007). Maternal and paternal age and risk of autism spectrum disorders. Archives of pediatrics & adolescent medicine, 161(4), 334-340.
-
Reichenberg, A., Gross, R., Weiser, M., Bresnahan, M., Silverman, J., Harlap, S., … & Knobler, H. Y. (2006). Advancing paternal age and autism. Archives of general psychiatry, 63(9), 1026-1032.
-
Chess, S., Fernandez, P., & Korn, S. (1978). Behavioral consequences of congenital rubella. The Journal of pediatrics, 93(4), 699-703.
-
Yamashita, Y., Fujimoto, C., Nakajima, E., Isagai, T., & Matsuishi, T. (2003). Possible association between congenital cytomegalovirus infection and autistic disorder. Journal of autism and developmental disorders, 33(4), 455-459.
-
Persico, A. M., & Bourgeron, T. (2006). Searching for ways out of the autism maze: genetic, epigenetic and environmental clues. Trends in neurosciences, 29(7), 349-358.
-
Folstein, S. E., & Rosen-Sheidley, B. (2001). Genetics of austim: complex aetiology for a heterogeneous disorder. Nature Reviews Genetics, 2(12), 943-955.
-
Deth, R., Muratore, C., Benzecry, J., Power-Charnitsky, V. A., & Waly, M. (2008). How environmental and genetic factors combine to cause autism: A redox/methylation hypothesis. Neurotoxicology, 29(1), 190-201.
-
Waly, M., Olteanu, H., Banerjee, R., Choi, S. W., Mason, J. B., Parker, B. S., … & Power-Charnitsky, V. A. (2004). Activation of methionine synthase by insulin-like growth factor-1 and dopamine: a target for neurodevelopmental toxins and thimerosal. Molecular psychiatry, 9(4), 358-370.
-
Boris, M., Goldblatt, A., Galanko, J., & James, S. J. (2004). Association of MTHFR gene variants with autism. J Am Phys Surg, 9(4), 106-8.
-
Frye, R. E., Slattery, J., Delhey, L., Furgerson, B., Strickland, T., Tippett, M., … & James, S. J. (2016). Folinic acid improves verbal communication in children with autism and language impairment: a randomized double-blind placebo-controlled trial. Molecular psychiatry.
-
James, S. J., Cutler, P., Melnyk, S., Jernigan, S., Janak, L., Gaylor, D. W., & Neubrander, J. A. (2004). Metabolic biomarkers of increased oxidative stress and impaired methylation capacity in children with autism. The American journal of clinical nutrition, 80(6), 1611-1617.
Haut-Darm-Hirn-, Hochsensibilitäts- & Mastzell-Community – kostenfrei!
Bleibe auf dem Laufenden über neueste Beiträge, Rezepte, exklusive, zeitgemäße Lifestyletipps, aktuelle Events, erhalte Gutscheine & persönliche Einblicke, die ich nicht öffentlich mit jedem teile. Für einen leichten Einstieg erhältst du hier kostenlos dein Exemplar meines E-Books, das mit den wichtigsten Zusammenfassungen meines Blogs einen Einstieg in mein Konzept liefert, mit vielen Tipps, die du gleich im Alltag ausprobieren kannst.
Feedback zu meinem Newsletter:
"...tausend Dank wieder mal für deine Arbeit. Immer wieder helfen mir deine Videos wieder meinen inneren Frieden zu finden und nicht so hart mit mir ins Gericht zu gehen."
"Danke dir [...] für deine wertvolle Arbeit, die du online mit uns teilst..."
Trage dich hier ein für Doro´s Newsletter + kostenloses E-Book + NEU Heilungsvisualisation MP3:


Pingback: Ich, der Autist – Philosophie des Gesundwerdens
Pingback: Moderne Tenside zerstören Barriereorgane – Philosophie des Gesundwerdens
Pingback: Die Gene sind unschuldig – Philosophie des Gesundwerdens
Pingback: Probleme, die unsere Vorfahren noch nicht hatten mit der Ernährung – Philosophie des Gesundwerdens
Pingback: Staub – was auch Nicht-Allergiker wissen sollten – Philosophie des Gesundwerdens